2024年4月Cell期刊精华
来源:生物谷原创 2024-04-30 10:59
科学家打造“混血大脑”,小鼠用大鼠嗅觉探索世界、人类肠道菌群中的隐性质粒有望成为识别水体粪便污染、炎症性肠病等健康问题的强大生物标志物
2024年4月份即将结束,4月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Cell:科学家打造“混血大脑”,小鼠用大鼠嗅觉探索世界
doi:10.1016/j.cell.2024.03.042
在一项新的研究中,美国哥伦比亚大学Kristin Baldwin教授领导的一个研究团队成功构建了拥有“混血大脑”的小鼠,它们能利用大鼠的神经元来感知气味。这是动物首次能够利用另一种动物的感觉器官来感知世界并做出准确反应,同时也表明了大脑在整合外部脑细胞方面的灵活性。相关研究结果发表在2024年4月25日的Cell期刊上,论文标题为“Functional sensory circuits built from neurons of two species”。
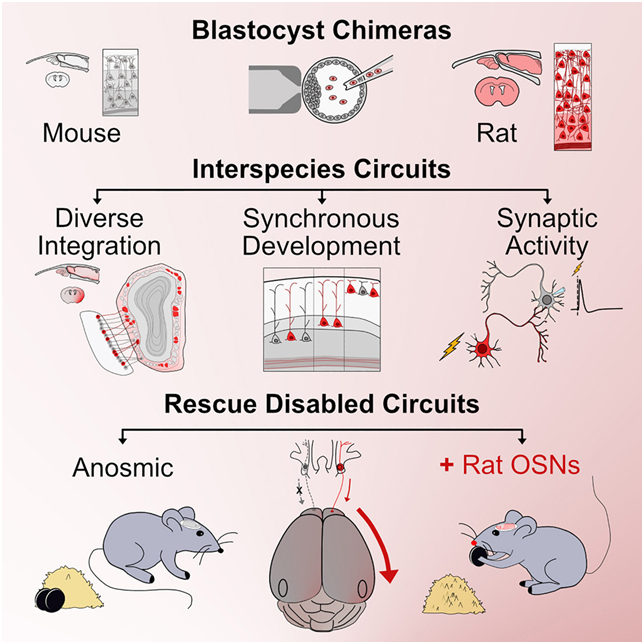
图片来自Cell, 2024, doi:10.1016/j.cell.2024.03.042
Baldwin说,“这项研究开始向我们展示,我们如何扩大大脑的灵活性,使其能够容纳来自人机界面或移植干细胞的其他类型输入。”
研究团队采用了前沿的“囊胚互补”技术,将大鼠干细胞注入小鼠早期胚胎中,使两种物种的细胞得以共生并自然整合,克服了传统移植技术的局限性。这一过程如同在小鼠大脑中巧妙植入了大鼠的嗅觉系统,使改造后的小鼠能够依靠“外来”神经元找到隐藏的食物,证明了大鼠神经元在小鼠大脑中的功能整合。
2.Cell:人类肠道菌群中的隐性质粒有望成为识别水体粪便污染、炎症性肠病等健康问题的强大生物标志物
doi:10.1016/j.cell.2024.01.039
在一项新的研究中,德国奥尔登堡大学亥姆霍兹海洋生物功能多样性研究所的A. Murat Eren教授领导的一个国际研究小组聚焦于人类肠道菌群中的一种成分:质粒,在此之前人们对它的研究很少。质粒是一种小型染色体外遗传元件,广泛存在于细菌细胞中,对微生物生活方式具有深远影响,但其在自然生态环境中的多样性却知之甚少。
在这项新的研究中,他们发现一种神秘的质粒是人类肠道中数量最多的遗传因子之一。这种质粒有可能成为一种强大的生物标志物,用于识别水的粪便污染等健康危害或炎症性肠病等人类疾病。根据他们的分析,这种质粒存在于工业化国家 90% 以上的人的肠道中。相关研究结果近期发表在Cell期刊上,论文标题为“A cryptic plasmid is among the most numerous genetic elements in the human gut”。

图片来自Cell, 2024, doi:10.1016/j.cell.2024.01.039
在这项新的研究中,他们仔细研究了这种隐性质粒,它只由两个基因组成,令人惊讶的是,这两个基因只能用于自身复制和在细菌细胞中移动,而没有其他明显的益处。为了更好地了解 pBI143 的生态学,他们分析了从不同栖息地产生的 6 万个人类宏基因组和 4 万个环境宏基因组。
Eren解释说,“我们发现 pBI143 有一系列非常有趣的特征。”他们发现,在工业化国家,90% 以上的人都携带这种隐性质粒,平均而言,它是人类肠道中数量最多的基因实体之一。他说,“平均而言,它的数量是病毒基因组的 10 倍以上,而病毒基因组以前被认为是人类肠道中数量最多的染色体外遗传物质。”
进一步的分析表明,这种隐性质粒几乎只出现在人类肠道中,但在海洋、土壤、植物和动物消化器官及其粪便等其他环境的数据集中几乎不存在。除受人类活动影响的环境如废水、医院表面和实验室大鼠样本外,研究人员仅能在极少数样本中检测到其特征基因序列。
3.Cell:利用新开发的显微镜技术FLASH-PAINT观察复杂的细胞内部运作
doi:10.1016/j.cell.2024.02.033
在一项新的研究中,来自美国耶鲁大学的研究人员开发了一种革命性的显微镜技术---“FLASH-PAINT”,它为我们揭开单个细胞内部运作的神秘面纱提供了前所未有的视角。这项技术的核心在于对成像探针的创新应用,通过在生物样本中使用特定化合物,显著提升科学家对微小细节的探测能力。相关研究结果发表在2024年3月28日的Cell期刊上,论文标题为“Unraveling cellular complexity with transient adapters in highly multiplexed super-resolution imaging”。
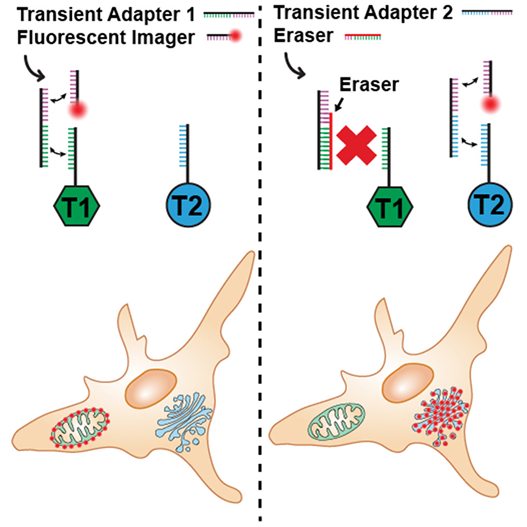
图片来自Cell, 2024, doi:10.1016/j.cell.2024.02.033
论文共同通讯作者、耶鲁大学细胞生物学教授Joerg Bewersdorf博士说,“若仅能观察一两蛋白,就如同管窥蠡测,难以洞察全局。而今,我们拥有一种优雅且高效的手段,可以随心所欲地对几乎无限数量的蛋白质和其他特征进行成像。”
目前一种可视化观察细胞内部过程的方法是将抗体与由单链 DNA 和荧光染料组成的成像探针结合使用。抗体引导探针到达需要成像的靶标,DNA 链与抗体上的互补“对接”DNA 链结合。
这种方法的一个局限是,每个靶标都需要它自己的成像探针。例如,如果一个团队想观察 10 种不同的靶标,就需要使用 10 种探针。论文第一作者、耶鲁大学细胞生物学副研究员Florian Schüder 博士说,“但是如果我们的设想是对细胞中的每种蛋白进行成像,那么大约有 2 万种不同的蛋白。”他说,“设想对细胞内所有2万余种蛋白质进行成像,现有技术显然无法胜任。”
为解决这一难题,研究团队引入了一种名为“衔接分子”(adapter)的中介物质,它能灵活连接任意类型的探针与任意类型的靶标。这项技术的关键在于,衔接分子与靶标的结合极为短暂,易于从一个靶标迅速转换至下一个。“这种快速切换能力至关重要,”Bewersdorf强调。
doi:10.1016/j.cell.2024.03.002
人体细胞分裂时,必须首先准确复制它的DNA。DNA 复制工作是所有生物体内最重要的过程之一,充满了突变的风险,可能导致细胞死亡或癌症。
如今,在一项新的研究中,来自美国宾夕法尼亚大学佩雷尔曼医学院和英国利兹大学的研究人员发现了细胞中的一种多蛋白“机器”,它能帮助控制 DNA 复制的暂停或停止,以确保DNA复制的顺利进行。这一发现加深了人们对DNA复制的理解,有助于解释一系列令人费解的遗传疾病,并可能为未来开发针对神经和发育疾病的治疗方法提供信息。相关研究结果于2024年3月29日在线发表在Cell期刊上,论文标题为“The SPATA5-SPATA5L1 ATPase complex directs replisome proteostasis to ensure genome integrity”。

图片来自Cell, 2024, doi:10.1016/j.cell.2024.03.002
论文共同通讯作者、宾夕法尼亚大学佩雷尔曼医学院癌症生物学系教授Roger Greenberg 博士说,“我们发现了细胞中的一种关键质量控制机制。我们体内每天都有数万亿个细胞进行分裂,这就需要准确复制我们的基因组。我们的研究描述了一种调节复制 DNA 中蛋白稳定性的新机制。我们如今对这一复杂生物过程中的一个重要步骤有了更多的了解。”
doi:10.1016/j.cell.2024.03.025
细胞包含多种称为“细胞器”的特殊结构,比如细胞核、线粒体或过氧物酶体。追溯细胞器的起源并确定其结构对于了解细胞功能以及与细胞器功能障碍相关的病理现象至关重要。
如今,在一项新的额研究中,来自瑞士日内瓦大学的研究人员将高分辨率显微镜和运动学重建技术相结合,在运动中可视化观察人类中心粒(centriole)的起源。这种细胞器对细胞骨架的组装至关重要,在功能障碍的情况下与某些癌症、脑部疾病或视网膜疾病有关。他们的发现阐明了中心粒组装的复杂性。它还为研究其他细胞器开辟了许多新途径。相关研究结果于2024年4月10日在线发表在Cell期刊上,论文标题为“Time-series reconstruction of the molecular architecture of human centriole assembly”。
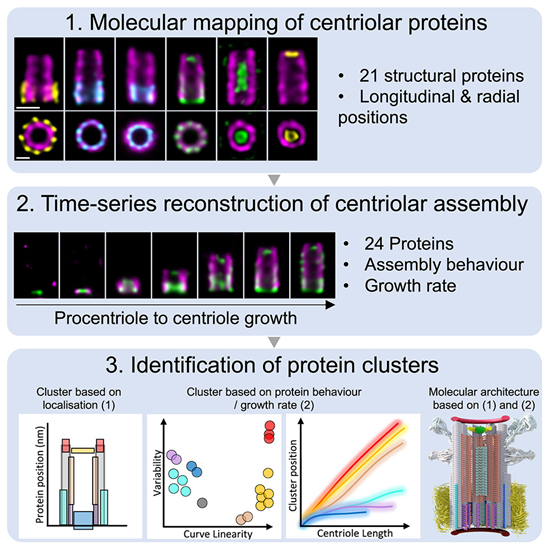
图片来自Cell, 2024, doi:10.1016/j.cell.2024.03.025
中心粒的情况尤其如此。这种细胞器的尺寸不到 500 纳米,由大约 100 种不同的蛋白组成,分为六个亚结构域。在几年之前,人们还无法看到中心粒结构的细节。
日内瓦大学理学院分子与细胞生物学系联合研究主任Paul Guichard和Virginie Hamel的实验室利用膨胀显微镜(expansion microscopy)技术改变了这一局面。这种前沿技术能使细胞及其成分在不变形的情况下逐渐膨胀,这样就能使用传统显微镜对它们进行高分辨率观察。
以如此高的分辨率获取中心粒图像,可以在特定时间准确定位蛋白,但却无法提供关于中心粒亚结构域或单个蛋白出现顺序的信息。论文第一作者Marine Laporte利用膨胀显微镜分析了1000多个中心粒在不同生长阶段的六个亚结构域中 24 种蛋白的位置。
6.Cell:新研究首次构建出人类串联重复序列扩增的遗传参考图谱
doi:10.1016/j.cell.2024.03.004
在一项新的研究中,来自美国加州大学欧文分校和加州大学洛杉矶分校的研究人员首次建立了多次重复的DNA短片段的遗传参考图谱,其中已知这些DNA短片段可导致50多种致命的人类疾病,包括肌萎缩性脊髓侧索硬化症、亨廷顿病和多种癌症。这种加州大学欧文分校串联基因组聚合数据库使得科学家们能够研究称为串联重复序列扩增(tandem repeat expansion)的突变与疾病的关系,从而更好地了解健康差异并改进临床诊断。相关研究结果于2024年4月5日在线发表在Cell期刊上,论文标题为“A genome-wide spectrum of tandem repeat expansions in 338,963 humans”。
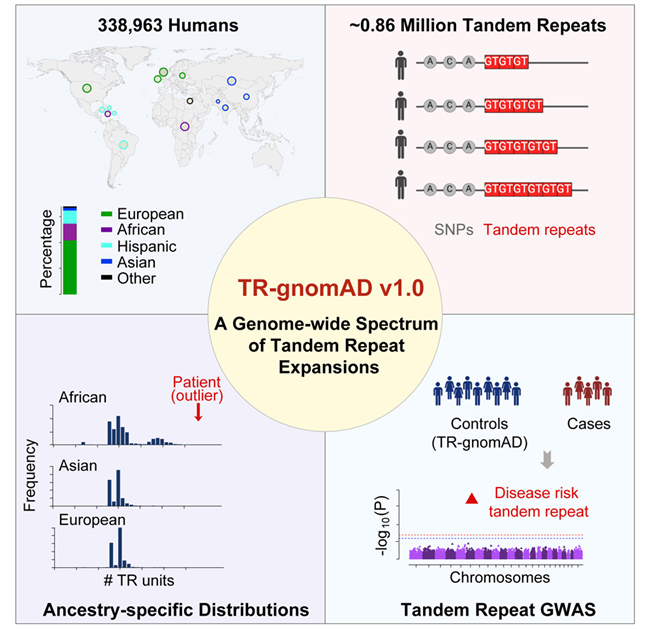
图片来自Cell, 2024, doi:10.1016/j.cell.2024.03.004
这项研究介绍了加州大学欧文分校的TR-gnomAD,它解决了目前生物库基因组测序工作中的一个关键缺口。尽管串联重复序列扩增约占人类基因组的6%,并对复杂的先天性疾病有重大影响,但科学界对它们的了解仍然有限。
论文共同通讯作者、加州大学欧文分校生物信息学教授Wei Li说,“这个开创性的项目弥补了解释遗传疾病患者中串联重复序列扩增能力方面的重大空白,从而使加州大学欧文分校成为人类遗传学和医学遗传学领域的领军者。TR-gnomAD提高了我们的能力,使我们能够根据这些基因突变在不同祖先间的变化来确定某些疾病可能会如何影响不同的人群。然后,遗传咨询公司就可以开发产品来解读这些信息,并准确报告某些性状可能与不同人群和疾病的关联。”
7.Cell:新研究成功构建出模拟 tau 蛋白聚集物扩散的人类神经元模型
doi:10.1016/j.cell.2024.03.015
在一项新的研究中,来自美国威尔康奈尔医学院的研究人员开发出一种创新的人类神经元模型,该模型能有力地模拟 tau 蛋白聚集物在大脑中的扩散---这一过程是阿尔茨海默病和额颞叶痴呆症认知能力下降的原因。通过这种新模型,他们发现了有可能阻止 tau 扩散的新型治疗靶点。这项临床前研究是阿尔茨海默病研究的重大进展。相关研究结果于2024年4月5日在线发表在Cell期刊上,论文标题为“Human iPSC 4R tauopathy model uncovers modifiers of tau propagation”。
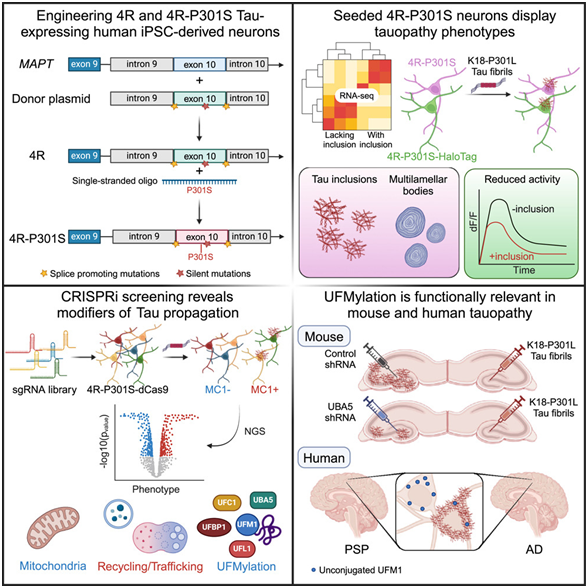
图片来自Cell, 2024, doi:10.1016/j.cell.2024.03.015
论文共同通讯作者Li Gan博士说,“目前没有任何疗法能够阻止阿尔茨海默病患者大脑中tau聚集物的扩散。我们的tau扩散人类神经元模型克服了以往模型的局限性,并揭示了以前未知的潜在靶点用于药物开发。”
人类诱导性多能干细胞(iPSC)可发育成人体的任何细胞,并可在实验室培养皿中诱导成为神经元,从而建立大脑疾病模型。然而,在这些所形成的神经元中建立tau传播模型几乎是不可能的,因为tau传播需要在衰老的大脑中进行数十年。
Gan博士及其团队利用CRISPR技术修改了人类iPSC的基因组,促使它们表达与患病的衰老大脑相关的tau形式。Gan博士说,“这种模型改变了游戏规则,它能在数周内模拟tau在神经元中的扩散,而这个过程在人脑中通常需要数十年。”
8.Cell:新研究构建出肠道细胞的空间图谱,并在肠道炎症过程中追踪它们的轨迹
doi:10.1016/j.cell.2024.03.013
肠道内的细胞发挥着多种作用,包括营养物吸收、感知和维持体内平衡。某些慢性疾病的明显特征是肠道炎症,这会破坏肠道细胞,导致肠道重塑并引入新的免疫细胞。
为了更好地了解肠道细胞的类型及其在肠道内的位置,来自美国布莱根妇女医院和波士顿儿童医院的研究人员利用一种称为MERFISH(multiplexed-error robust-fluorescence in situ hybridization, 多路抗错荧光原位杂交)的新技术,分析了小鼠结肠炎模型中135万个肠道细胞中的940个基因。相关研究结果发表在2024年4月11日的Cell期刊上,论文标题为“Charting the cellular biogeography in colitis reveals fibroblast trajectories and coordinated spatial remodeling”。
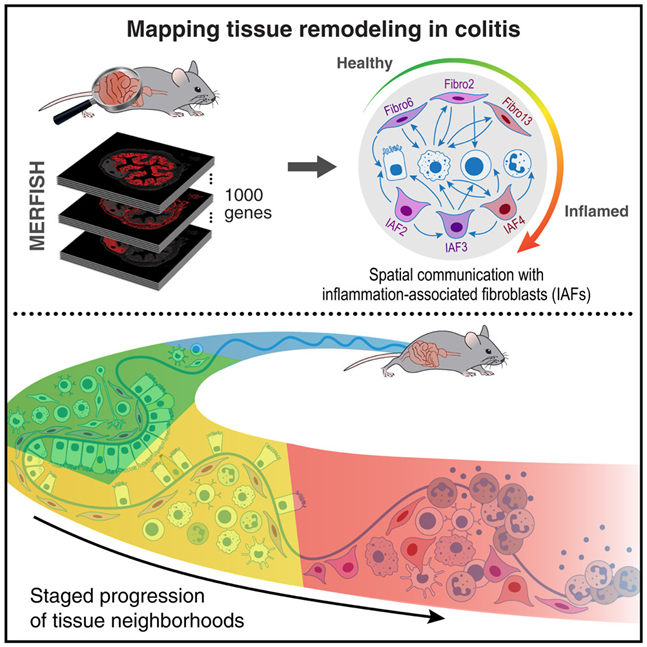
图片来自Cell, 2024, doi:10.1016/j.cell.2024.03.013
他们确定了与健康和炎症状态相关的细胞群体,绘制了它们的空间邻域图,并追踪了这些细胞群体在炎症过程中的演变。其中一种重要的细胞类型是成纤维细胞,当处于不良状态时,它们可产生炎症相关成纤维细胞(inflammation associated fibroblast, IAF),这可能有助于重塑胞外基质、招募免疫细胞并产生炎症性细胞因子。
然而,一些关键问题仍然存在,包括IAF群体的具体多样性、它们的精确组织位置以及它们在炎症期间是如何出现的。尽管如此,这些作者仍能构建出小鼠结肠在健康状态和肠道炎症期间的独特空间图谱,这有可能有助于慢性炎症性疾病的治疗。
doi:10.1016/j.cell.2024.02.045
在一项新的研究中,德国慕尼黑大学和马克斯普朗克生物化学研究所的Eduard Unterauer及其团队开发出了一种新的超分辨率高通量成像方法:SUM-PAINT。利用这项新技术,他们构建出具有单分子分辨率的三维神经元图谱,并发现了一种以前未知的突触类型。SUM-PAINT是超分辨率显微镜的一项新技术发展,首次允许对大量蛋白进行非常快速和几乎无限制的可视化观察和绘图。相关研究结果发表在2024年3月28日的Cell期刊上,论文标题为“Spatial proteomics in neurons at single-protein resolution”。
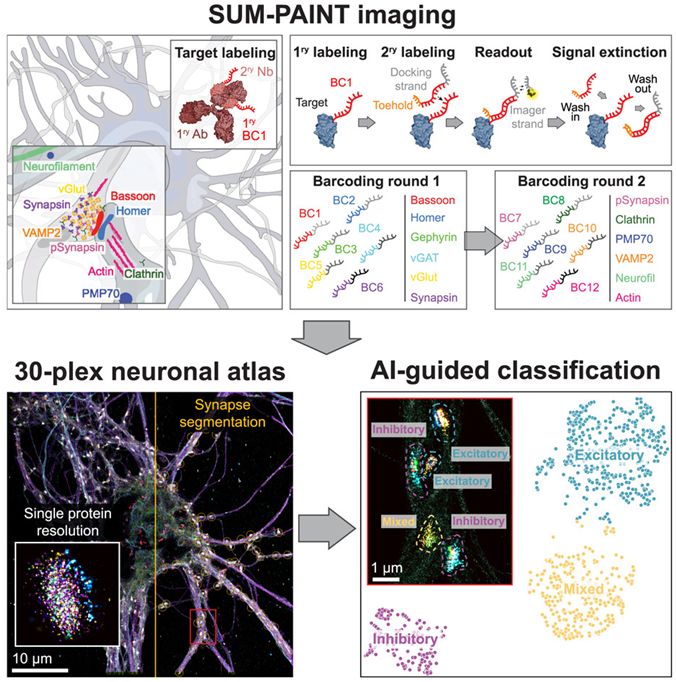
图片来自Cell, 2024, doi:10.1016/j.cell.2024.02.045
Unterauer 说,“生命系统的复杂性包括从整个生物体和组织,到错综复杂的细胞网络结构,再到单个生物分子的组装和相互作用。要全面了解这种复杂性,必须同时研究单个生物分子的位置、特性和相互作用。这种结合多种信号的方法被称为多路复用法(multiplexing method)全面了解蛋白结构,必须克服四个关键挑战:灵敏度、通量、空间分辨率和复用能力。”
这些作者着重关注大脑中神经元的复杂环境,首次为30种不同类型的蛋白绘制了具有单分子分辨率的神经元图谱。随着通量和复用能力的提高,他们得以揭示近900个突触的突触蛋白组成的复杂性。
为了进一步探索这些大型数据集,这些作者开发出一种基于机器学习的分析管道。通过分析这些成像数据集中的1600个特征,如蛋白含量、分布或形状,他们发现了一种以前未知的化学突触类型。这些突触只占所有突触的 1%,而其他成像技术无法检测到它们。
10.揭秘肿瘤微宇宙!Cell:科学家成功绘制出癌症转移过程中详细的微生物群落目录
doi:10.1016/j.cell.2024.03.021
微生物群定植在人类机体的多个生境中,不仅塑造着宿主免疫系统的稳态,更在抗癌治疗效果中扮演着关键角色。最新研究发现,复杂的微生物群落甚至可能潜藏于原发性肿瘤的核心地带。
近日,一篇发表在国际杂志Cell上题为“A pan-cancer analysis of the microbiome in metastatic cancer”的研究报告中,来自荷兰癌症研究所等机构的科学家们通过研究编制了一份详实的转移性癌症中细菌名录,当分析了4000多份肿瘤样本后,研究人员揭示了这些共生微生物的多样性和它们如何与癌细胞、周边环境相互作用的微妙机制,例如某些特定细菌与患者对免疫疗法的不良反应存在关联。
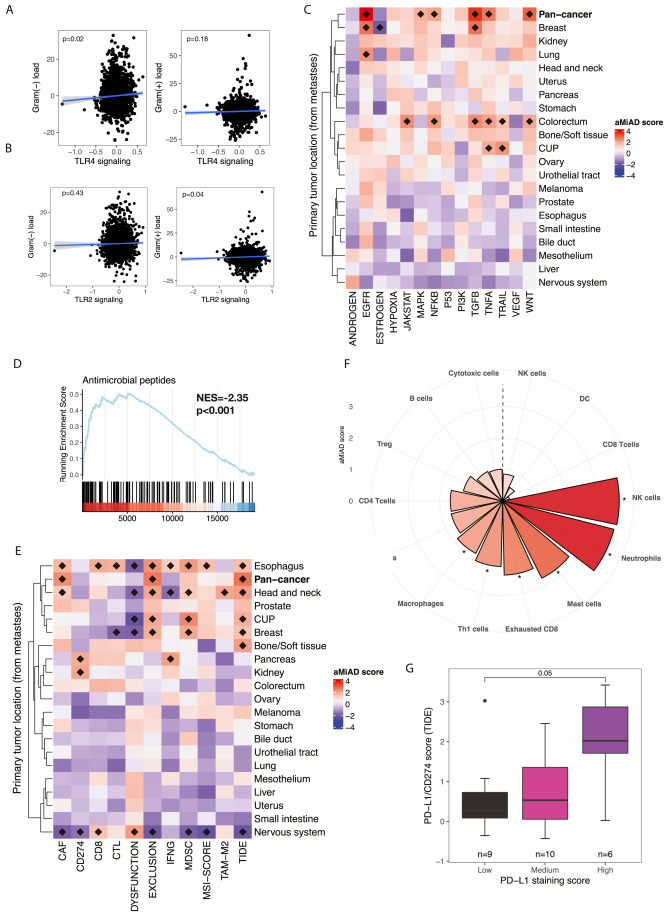
科学家成功绘制出癌症转移过程中详细的微生物群落目录
图片来源:Cell (2024). DOI:10.1016/j.cell.2024.03.021
此项研究不仅为科学家们深入理解微生物如何助力抑癌或对抗疗法提供了新途径,更为优化患者治疗方案、挖掘潜在益生菌资源指明了方向。在我们体内生存着数十亿的微生物,包括细菌、病毒和酵母等,其总称为微生物组(microbiome),我们需要它们,同时它们也需要我们;比如,细菌能帮助我们消化食物,与宿主机体免疫系统相互合作来抵御病原体入侵、尤其是人类肠道菌群如今已经被进行了广泛地研究,包括在癌症发生的背景下,比如,其会影响免疫疗法和化疗的有效性。
然而,微生物并非仅限于肠道内,它们亦隐匿于肿瘤之中。随着技术进步,科研人员得以更精准地揭示这些“隐秘居民”的身份,尽管对其如何进入肿瘤、在肿瘤内具体作用机制尚不完全明了,但其对疾病进程及疗法效果的重要性不容忽视。
鉴于癌症转移往往是患者预后不良的主要原因,且现有疗法多针对转移灶,研究人员将目光聚焦于这些转移性肿瘤中的微生物。面对这一相对未知的领域,他们携手合作,首次绘制出癌症转移过程中细菌分布的全景图。通过对涵盖26种癌症类型的4000余例转移性组织样本进行DNA测序,科学家们不仅揭示了其中人类细胞的遗传信息,还捕获到了细菌的痕迹,因为无论是人类还是微生物,其遗传物质皆由DNA构成。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


